Estructura atómica y molecular
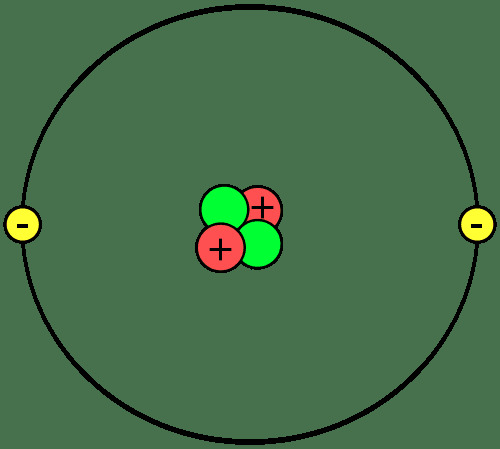
Los componentes básicos de la materia son átomos, que se unen para formar moléculas o compuestos. Es importante conocer las partes de un átomo, qué son los iones e isótopos y cómo se unen los átomos.
Partes de un átomo
Los átomos están formados por tres componentes:
- protones - carga eléctrica positiva
- neutrones - sin carga eléctrica
- electrones - carga eléctrica negativa
Los protones y los neutrones forman el núcleo o centro de cada átomo. Los electrones orbitan el núcleo. Entonces, el núcleo de cada átomo tiene una carga neta positiva, mientras que la porción externa del átomo tiene una carga neta negativa. En las reacciones químicas, los átomos pierden, ganan o comparten electrones. El núcleo no participa en reacciones químicas ordinarias, aunque la desintegración nuclear y las reacciones nucleares pueden causar cambios en el núcleo atómico.
Átomos, iones e isótopos
El número de protones en un átomo determina qué elemento es. Cada elemento tiene una o dos letras símbolo que se usa para identificarlo en fórmulas químicas y reacciones. El símbolo del helio es Él. Un átomo con dos protones es un átomo de helio, independientemente de cuántos neutrones o electrones tenga. Un átomo puede tener la misma cantidad de protones, neutrones y electrones o la cantidad de neutrones y / o electrones puede diferir de la cantidad de protones.
Los átomos que llevan una carga eléctrica neta positiva o negativa son iones. Por ejemplo, si un átomo de helio pierde dos electrones, tendría una carga neta de +2, que se escribiría He2+.
Variando el número de neutrones en un átomo determina qué isótopo de un elemento que es. Los átomos pueden escribirse con símbolos nucleares para identificar su isótopo, donde se encuentra el número de nucleones (protones más neutrones) se enumera arriba y a la izquierda de un símbolo de elemento, con el número de protones enumerados a continuación y a la izquierda del símbolo. Por ejemplo, tres isótopos de hidrógeno son:
11H 21H 31H
Como sabe que el número de protones nunca cambia para un átomo de un elemento, los isótopos se escriben más comúnmente usando el símbolo del elemento y el número de nucleones. Por ejemplo, podría escribir H-1, H-2 y H-3 para los tres isótopos de hidrógeno o U-236 y U-238 para dos isótopos comunes de uranio.
Número atómico y peso atómico
los número atómico de un átomo identifica su elemento y su número de protones. los peso atomico es la cantidad de protones más la cantidad de neutrones en un elemento (porque la masa de electrones es tan pequeña en comparación con la de protones y neutrones que esencialmente no cuenta). El peso atómico a veces se llama masa atómica o el número de masa atómica. El número atómico de helio es 2. El peso atómico del helio es 4. Tenga en cuenta que la masa atómica de un elemento en la tabla periódica no es un número entero. Por ejemplo, la masa atómica de helio se da como 4.003 en lugar de 4. Esto se debe a que la tabla periódica refleja la abundancia natural de isótopos de un elemento. En los cálculos de química, utiliza la masa atómica dada en la tabla periódica, suponiendo que una muestra de un elemento refleje el rango natural de isótopos para ese elemento.
Moléculas
Los átomos interactúan entre sí, a menudo formando enlaces químicos entre sí. Cuando dos o más átomos se unen entre sí, forman una molécula. Una molécula puede ser simple, como H2o más complejo, como C6H12O6. Los subíndices indican el número de cada tipo de átomo en una molécula. El primer ejemplo describe una molécula formada por dos átomos de hidrógeno. El segundo ejemplo describe una molécula formada por 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. Si bien podría escribir los átomos en cualquier orden, la convención es escribir primero el pasado cargado positivamente de una molécula, seguido de la parte cargada negativamente de la molécula. Entonces, el cloruro de sodio se escribe NaCl y no ClNa.
Tabla Periódica Notas y Revisión
La tabla periódica es una herramienta importante en química. Estas notas revisan la tabla periódica, cómo está organizada y las tendencias de la tabla periódica.
Invención y organización de la tabla periódica
En 1869 Dmitri Mendeleev organizó los elementos químicos en una tabla periódica muy parecida a la que usamos hoy, excepto sus elementos se ordenaron de acuerdo con el aumento del peso atómico, mientras que la mesa moderna se organiza aumentando número. La forma en que se organizan los elementos permite ver tendencias en las propiedades de los elementos y predecir el comportamiento de los elementos en las reacciones químicas.
Las filas (que se mueven de izquierda a derecha) se llaman períodos. Los elementos en un período comparten el mismo nivel de energía más alto para un electrón no excitado. Hay más subniveles por nivel de energía a medida que aumenta el tamaño del átomo, por lo que hay más elementos en períodos más abajo en la tabla.
Las columnas (que se mueven de arriba a abajo) forman la base del elemento grupos. Los elementos en grupos comparten el mismo número de electrones de valencia o disposición de capa externa de electrones, lo que le da a los elementos en un grupo varias propiedades comunes. Ejemplos de grupos de elementos son los metales alcalinos y los gases nobles.
Tabla periódica Tendencias o periodicidad
La organización de la tabla periódica permite ver las tendencias en las propiedades de los elementos de un vistazo. Las tendencias importantes se relacionan con un radio atómico, energía de ionización, electronegatividad y afinidad electrónica.
-
Radio atómico
El radio atómico refleja el tamaño de un átomo. Radio atómico disminuye el movimiento de izquierda a derecha a través de un período y aumenta el movimiento de arriba a abajo abajo un grupo de elementos. Aunque podría pensar que los átomos simplemente se volverían más grandes a medida que ganaran más electrones, los electrones permanecen en una capa, mientras que el número creciente de protones atrae las capas más cerca del núcleo. Bajando un grupo, los electrones se encuentran más lejos del núcleo en nuevas capas de energía, por lo que aumenta el tamaño total del átomo. -
Energía de ionización
La energía de ionización es la cantidad de energía necesaria para eliminar un electrón de un ion o átomo en estado gaseoso. Energía de ionización aumenta el movimiento de izquierda a derecha a través de un período y disminuye moviéndose de arriba a abajo Abajo un grupo. -
Electronegatividad
La electronegatividad es una medida de la facilidad con que un átomo forma un enlace químico. Cuanto mayor es la electronegatividad, mayor es la atracción para unir un electrón. Electronegatividad disminuye el movimiento hacia abajo de un grupo de elementos. Los elementos en el lado izquierdo de la tabla periódica tienden a ser electropositivos o más propensos a donar un electrón que aceptar uno. -
Afinidad electronica
La afinidad electrónica refleja cuán fácilmente un átomo aceptará un electrón. Afinidad electronica varía según el grupo de elementos. Los gases nobles tienen afinidades electrónicas cercanas a cero porque tienen capas de electrones llenas. Los halógenos tienen altas afinidades electrónicas porque la adición de un electrón le da al átomo una capa de electrones completamente llena.
Enlaces Químicos y Vinculación

Enlaces químicos son fáciles de entender si tiene en cuenta las siguientes propiedades de los átomos y electrones:
- Los átomos buscan la configuración más estable.
- La regla del octeto establece que los átomos con 8 electrones en su orbital externo serán más estables.
- Los átomos pueden compartir, dar o tomar electrones de otros átomos. Estas son formas de enlaces químicos.
- Los enlaces se producen entre los electrones de valencia de los átomos, no los electrones internos.
Tipos de enlaces químicos
Los dos tipos principales de enlaces químicos son los enlaces iónicos y covalentes, pero debe tener en cuenta varias formas de enlace:
-
Enlaces iónicos
Enlaces iónicos se forman cuando un átomo toma un electrón de otro átomo. Ejemplo: el NaCl está formado por un enlace iónico donde el sodio dona su electrón de valencia al cloro. El cloro es un halógeno. Todos los halógenos tienen 7 electrones de valencia y necesitan uno más para obtener un octeto estable. El sodio es un metal alcalino. Todos los metales alcalinos tienen 1 electrón de valencia, que donan fácilmente para formar un enlace. -
Bonos Covalentes
Enlaces covalentes se forman cuando los átomos comparten electrones. Realmente, la principal diferencia es que los electrones en los enlaces iónicos están más estrechamente asociados con un átomo núcleo u otro, cuyos electrones en un enlace covalente tienen la misma probabilidad de orbitar un núcleo que el otro. Si el electrón está más estrechamente asociado con un átomo que con el otro, un enlace covalente polar puede formar Ejemplo: se forman enlaces covalentes entre hidrógeno y oxígeno en el agua, H2O. -
Enlace metálico
Cuando los dos átomos son ambos metales, se forma un enlace metálico. La diferencia en un metal es que los electrones podrían ser cualquier átomo de metal, no solo dos átomos en un compuesto. Ejemplo: los enlaces metálicos se ven en muestras de metales elementales puros, como oro o aluminio, o aleaciones, como latón o bronce.
Tal vez se pregunte cómo puede saber si un enlace es iónico o covalente. Puede ver la ubicación de los elementos en la tabla periódica o en una tabla de elementos. electronegatividades para predecir el tipo de enlace que se formará. Si los valores de electronegatividad son muy diferentes entre sí, se formará un enlace iónico. Por lo general, el catión es un metal y el anión no es un metal. Si ambos elementos son metales, espere que se forme un enlace metálico. Si los valores de electronegatividad son similares, espere que se forme un enlace covalente. Los enlaces entre dos no metales son enlaces covalentes. Los enlaces covalentes polares se forman entre elementos que tienen diferencias intermedias entre los valores de electronegatividad.
Cómo nombrar compuestos - Nomenclatura química
Para que los químicos y otros científicos se comuniquen entre sí, la Unión Internacional de Química Pura y Aplicada o IUPAC acordó un sistema de nomenclatura o denominación. Escuchará los productos químicos llamados sus nombres comunes (por ejemplo, sal, azúcar y bicarbonato de sodio), pero en el laboratorio usaría nombres sistemáticos (por ejemplo, cloruro de sodio, sacarosa y bicarbonato de sodio). Aquí hay una revisión de algunos puntos clave sobre la nomenclatura.
Nombrar compuestos binarios
Los compuestos pueden estar formados por solo dos elementos (compuestos binarios) o más de dos elementos. Se aplican ciertas reglas al nombrar compuestos binarios:
- Si uno de los elementos es un metal, se nombra primero.
- Algunos metales pueden formar más de un ion positivo. Es común indicar la carga en el ion usando números romanos. Por ejemplo, FeCl2 es cloruro de hierro (II).
- Si el segundo elemento es un no metal, el nombre del compuesto es el nombre del metal seguido de una raíz (abreviatura) del nombre del no metal seguido de "ide". Por ejemplo, el NaCl se llama cloruro de sodio.
- Para los compuestos que consisten en dos no metales, el elemento más electropositivo se nombra primero. Se nombra la raíz del segundo elemento, seguido de "ide". Un ejemplo es el HCl, que es cloruro de hidrógeno.
Nombrar compuestos iónicos
Además de las reglas para nombrar compuestos binarios, existen convenciones de nomenclatura adicionales para compuestos iónicos:
- Algunos aniones poliatómicos contienen oxígeno. Si un elemento forma dos oxianiones, el que tiene menos oxígeno termina en -ite mientras que el que tiene más oxgyen termina en -ate. Por ejemplo:
NO2- es nitrito
NO3- es nitrato